3月7日,作为国内未盈利生物医药公司之一的华领制药(02552-HK)发布了全年的业绩。
据业绩报显示,公司经调整亏损同比增加86.3%至人民币2.79亿元。除了亏损加大外,公司今年的研发支出费用持续高走,全年研发支出同比增长114.7%至2.69亿元人民币(单位下同)。这主要的原因是华领制药目前并无主营收入,收入只来源于银行的利息与政府的补贴。因之,随着公司的产品管线投资的加大,亏损敞口就会加大。
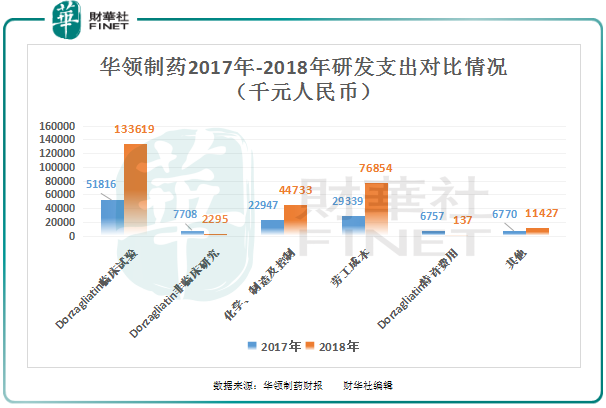
从公司的研发支出上看,华领制药的研发支出增加主要来源三大项目,即Dorzagliatin临床试验、化学、制造及控制及劳工成本。
Dorzagliatin临床试验研发开支同比增长157%至1.336亿元,主要增长的原因是由于III期临床试验进展及2018年开展的额外I期临床试验有关的成本增加。
化学、制造及控制研发开支同比增长94.94%至4473万元,主要增长的原因是在2018年完成API制造工艺验证所致;
劳工成本研发开支同比增长161.95%至7685万元,主要增长的原因是由于员工人数从20名增至75名,导致现金薪酬增加2270万元及以股份为基础的付款增加2480万元。

从公司的产品管线上看,公司目前有四个试验批次,七个产品正在开发中。其中, Dorzagliatin(HMS5552)和 mGLUR5是华领医药主要有两个核心产品。核心产品 Dorzagliatin HMM030用于治疗2型糖尿病,是该公司目前最接近进入市场的产品,也是全球第一个进入第III期临床试验的葡萄糖激酶激活剂(GKA)。截至2019年2月28日,公司已完成逾450名患者的招募,预计于2019年第四季度前发布首个24周结果。
对于治疗帕金森病患者左旋多巴诱发的功能障碍的mGLUR5(HMM0112),公司将计划的临床前研究。基于该等研究的结果,公司计划随后于2020年作出Go/No GO决策。
Dorzagliatin+Metformin是针对具有二甲双胍耐药性的2型糖尿病患者。该产品已经进行到III期临床试验。预计将于2019年中期前完成招募,并于2020年第一季度前发布首个24周结果。
Dorzagliatin+DPP-4(西格列汀)是针对具有2型糖尿病患者。目前处于I期临床试验阶段。公司已发布于2019年1月服药的首位患者,预计将于2019年年底前完成试验并发布结果。
试验HMM0112中的产品是针对具有2型糖尿病患者。目前处于I期临床试验。公司已确定临床地点,预计将于2019年上半年让首位患者服药,预计将于2019年年底前完成试验并发布结果。
从产品管线进度上看,公司有两项产品处于III期临床试验阶段,华领制药预计在2019年第四季度前发布单药疗法试验(HMM0301)的首个24周III期临床试验结果,于2020年第一季度前发布与二甲双胍联合用药试验(HMM0302)的首个24周III期结果。 对此,华领制药的产品在2019年仍然未商业化,那么2019年公司是亏损可能随着产品管线投资的加大,亏损敞口会更大。
3月8日上午,华领制药在港举行2018年全年业绩发布会,执行董事、首席执行官兼首席科学官陈力博士携执行董事、执行副总裁及首席财务官林洁诚出席并答记者问。
陈力博士现场表示,公司在中国的新药申请基本在10到12月之内进行批复,预期在2021年中期可以正式上市,且公司可能会进行一些产品的引进,可能有一到两个亿的投入。
A:(陈力)修复人体的传感器,修复人体的血糖调节,作为一个新的治疗方法,通常需要10年以上的临床研究才能最终临床试验确认安全有效性以及对患者的保护作用。目前我们已经完成了前面很重要的两个阶段,一个是它的安全性和耐受性。第二个是在二期临床验证它的科学性以及治疗效果。三期临床在二期的基础上在更多的患者人群中重复相关实验,最终确认临床用药标准。
估计两个临床试验有1000多个病人参与研究,进度上在今年的第四季度可以报道一部分糖尿病患者的治疗结果,期待比二期更好。另一个治疗二甲双胍用药失败的患者,加上我们的药来治疗糖尿病。预期在明年年初可以给大家报导。
希望通过这两个实验结果,动物实验的结果,以及药物生产的结果,向中国药监局递交新药上市申请。中国的新药申请基本在10到12月之内进行批复,我们预期在2021年中期可以正式上市。
A:(陈力)作为一个口服的降糖药,目前中国医保对于降糖药的保护的范围大概在6000至7000元,我们的价格可能不会比这个价格高太多。具体依然要有公司市场部、产业开发部和药价局共同商讨之后定下来。
A:(陈力)我们按照预期完成两个三期临床,四个一起临床都是为了申报新药上市,然后还要完成药物的生产化进程,这个总体上在8亿左右。如果明年会加速对糖尿病个性化治疗投入,我们有可能会2个亿在新的领域。还有一种可能,国外药厂在国外上市,有的药和我们的药有比较好的协同作用,能够扩大产品管线,我们可能会进行一些产品的引进,可能有一到两个亿的投入。
财华网所刊载内容之知识产权为财华网及相关权利人专属所有或持有。未经许可,禁止进行转载、摘编、复制及建立镜像等任何使用。
如有意愿转载,请发邮件至content@finet.com.hk,获得书面确认及授权后,方可转载。
更多精彩内容,请登陆
财华香港网(https://www.finet.hk/)
财华智库网(https://www.finet.com.cn)
现代电视(http://www.fintv.hk)