日前,国家药监局发布消息,批准齐鲁制药的贝伐珠单抗注射液安可达®上市的注册申请。该药是国内获批的首个贝伐珠单抗生物类似药,主要用于晚期、转移性或复发性非小细胞肺癌、转移性结直肠癌患者的治疗。

贝伐珠单抗是一种以VEGF为靶点重组的人源化单克隆抗体。原研药由罗氏开发,2010年在中国上市,先后获批用于转移性结直肠癌和晚期非鳞状非小细胞肺癌的治疗;2017年底通过谈判进入医保后迅速放量,2018年销售额达20亿。
由于齐鲁制药的安可达®获批的适应症与原研药相同,因此将拥有挤占原研市场的先机。当前国内贝伐珠单抗类似药的竞争格局较为激烈。齐鲁制药之后,有信达生物(01801-HK)、恒瑞医药(600276-CN)、复宏汉霖(02696-HK)等多家研发实力强劲的医药上市公司紧追。
值得一提的是,国内的重磅品种生物类似药已到达密集上市的前夜。截至2019年12月,利妥昔单抗类似药(复宏汉霖)和阿达木单抗类似药(百奥泰)已经获批,PD-(L)1、HER2、TNF-α和VEGFA四大靶点的单抗药物已有相关产品提交上市申请;就上市药企来说,复宏汉霖和信达生物各有3个品种处于NDA或已上市状态,地位较为领先。
欧洲是生物类似药研发最早也是最为成熟的市场。按照它在2005年发布的《生物类似药指南》中的定义,生物类似药是指在在质量、安全性和有效性上与已获批生物药高度相似的生物制剂。
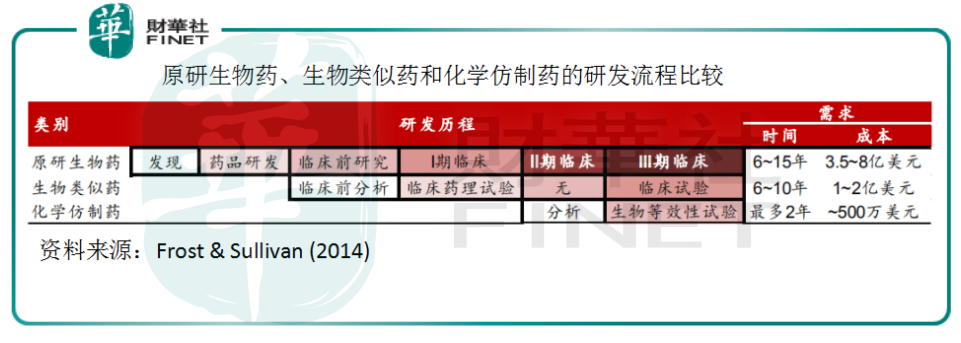
从原研生物药和生物类似药的研发流程上看,研发生物类似药不必经过药物发现和药品研发等临床前阶段的流程,也无需进行临床2期实验——临床中期只要通过药理实验,再补一个临床试验即可。从流程上就可以解释为何生物类似药的研发成本仅为原研的1/4,研发需时最多为10年。
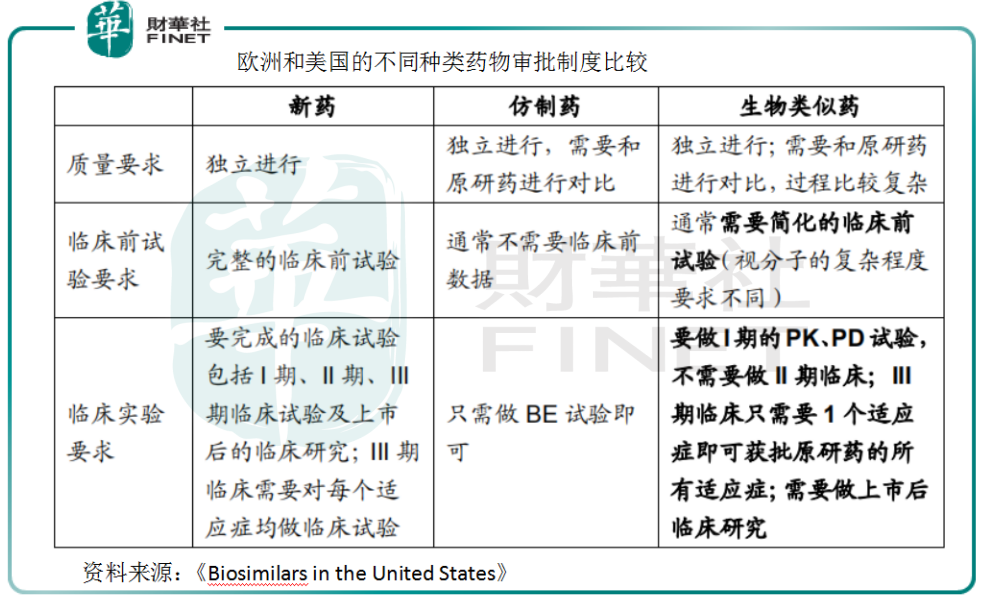
生物类似药还有一个优势,就是它有专门审批的通道。EMA(欧洲)和FDA(美国)均规定,在有充分的科学认证情况下,生物类似药在临床3期只需要1个适应症试验成功即可获批原研药所有的适应症。而中国的生物类似药审批政策也逐渐与国际接轨。
目前,国内已经有药企在尝试进行不需要临床2期实验的生物类似药审批流程,比如已经上市的复宏汉霖的利妥昔单抗类似药。这是一款到目前为止商业最成功的单抗类似药,主要是因为它是国内第一个获批上市(2019年2月)的单抗,具备先发优势;获批适应较多,涵括了淋巴瘤和自身免疫疾病两大领域;尚未有其它同靶点单抗被证疗效更优。
而更为重要的是,由于生物类似药本身具有原研药的成本优势,因而在医保覆盖程度增加,药品价格谈判降价等政策下仍然保持较大的折价空间。以复宏汉霖的利妥昔单抗类似药为例,利妥昔单抗是2017年年底36个高价药谈判品种之一,其类似药的单价(100mg/10ml/瓶)近期在广西、上海两地的价格仅为原研(2294.22元)的7折,这就直接促使它在2018年销量的大提升。
由此可见,政策提高市场的接受度和终端对治疗性药物的可及性,从供给侧的角度,单抗类似药以研发时间成本和费用成本更低、临床疗效相近等优势争夺原研药的存量市场,以价换量的效果明显,原研药在国内独占的局面将被打破。
Nature Reviews Drug Discovery的研究发现,VEGF抗体不仅能够抑制血管生成,其介导的信号对肿瘤干细胞形成有着至关重要的作用。目前,以VEGF为靶点的生物抗体药物相关适应症主要分为癌症和眼底血管增生;其中贝伐珠单抗针对癌症,主要包括转移性结直肠癌和非小细胞肺癌。
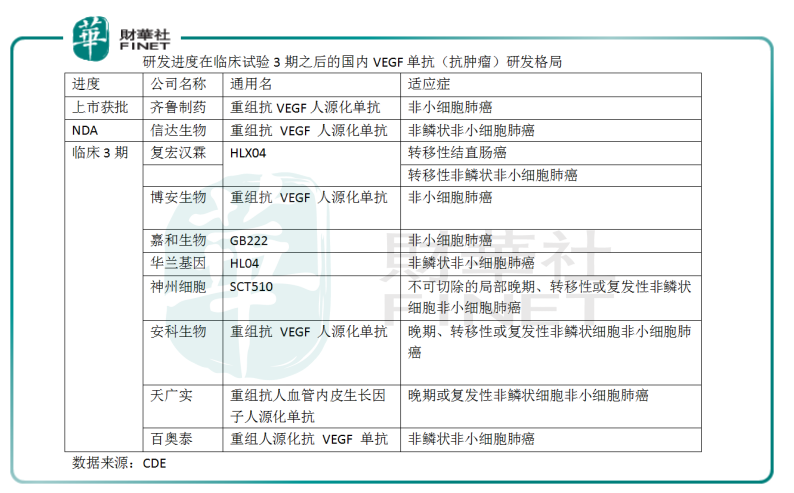
在国内,无论是以VEGF为靶点的抗体药研发,还是贝伐珠单抗类似药研发,竞争格局都较为激烈:有约28种VEGF单抗药物处于临床试验的各阶段,其中18种的适应症为癌症,涉及13家药企。从这18种药物研发进度来看,大部分扎堆在临床试验的1期和3期;治疗领域大多集中在非小细胞肺癌。
齐鲁制药的贝伐珠单抗类似药上市之后,国内还有信达生物、复宏汉霖、百奥泰等药企面临;信达生物的贝伐珠单抗类似药目前处于NDA阶段(补充任务资料第二轮),进度稍领先。在已上市的以单抗为主的药企中,信达生物的估值最高,市值超过330亿港元。值得注意的是较早前信达生物的PD-1单抗(霍奇性淋巴瘤)降价进入医保,医改红利兑现令人期待。
财华网所刊载内容之知识产权为财华网及相关权利人专属所有或持有。未经许可,禁止进行转载、摘编、复制及建立镜像等任何使用。
如有意愿转载,请发邮件至content@finet.com.hk,获得书面确认及授权后,方可转载。
更多精彩内容,请登陆
财华香港网(https://www.finet.hk/)
财华智库网(https://www.finet.com.cn)
现代电视(http://www.fintv.hk)