在新冠肺炎疫情全球蔓延的當下,疫苗研發備受市場關注,相關上市公司疫苗研發進度快慢,成為資本市場投資冷熱的最直接評判標準之一。
近日,復星醫藥(600196-CN;02196-HK)在新冠病毒mRNA疫苗臨床階段取得建設性的進展。至此,市場資金不斷湧入,助推復星醫藥股價創出新高。
近日,復星醫藥發佈公告稱,獲德國BioNTech SE(簡稱「BioNTech」)授權的mRNA疫苗BNT162b1獲得國家藥品監督管理局臨床試驗批準,並將於江蘇泰州開展I期臨床試驗,標志著該款mRNA疫苗在中國臨床試驗邁出重要的第一步。
復星醫藥作為獲得BioNTech mRNA疫苗產品在中國大陸及港澳台地區獨家開發和商業化授權的藥企。復星醫藥將負責推進該產品在中國大陸及港澳台地區的臨床試驗、上市申請、市場銷售。BioNTech將負責提供區域内臨床試驗申請所需的技術材料和臨床前研究數據、配合區域内臨床試驗,並供應相關臨床試驗及市場銷售所需的產品。
據悉,BioNTech開發的BNT162b1是一款靶向刺突蛋白上與細胞受體結合的受體結合域(RBD)的mRNA疫苗。在美國的1/2期初步結果數據顯示,疫苗安全性和可耐受性良好。mRNA是一種攜帶遺傳信息的核酸分子。mRNA疫苗將遺傳信息導入體内,使得體内細胞產生相應抗原,從而誘導人體產生中和抗體並刺激T細胞應答,通過體液免疫及細胞免疫的雙重機制對抗病毒。面對突發的重大疫情,和傳統疫苗相比,mRNA疫苗合成和生產工藝相對便捷,具有強大的免疫原性,不需要傳統疫苗必需的附加佐劑,安全性好。
值得注意的是,目前全球範圍内共有23種新冠疫苗進入臨床階段,面對突發的重大疫情,和傳統疫苗相比,mRNA疫苗合成和生產工藝相對便捷,具有強大的免疫原性,不需要傳統疫苗必需的附加佐劑,安全性好。根據BioNTech最新公開信息顯示,其基於mRNA的新型冠狀病毒疫苗在1/2期臨床試驗中取得積極結果,其中最先進的兩款基於mRNA的候選疫苗BNT162b1和BNT162b2於近期獲得美國食品和藥物管理局(美國FDA)的快速通道資格(Fast Track designation)
基於BNT162b1疫苗具備較高的安全性和可耐受性,美國更是直接開出19.5億美元確保獲得輝瑞與BioNTech的該款疫苗。此外,輝瑞方面表示,如果正在進行的研究成功,輝瑞和BioNTech準備在2020年10月之前尋求有條件的銷售授權或某種形式的監管批準。預計到2020年底在全球生產多達1億劑,並且可能到2021年底將超過13億劑。
基於新冠病毒mRNA疫苗在國内進入臨床試驗,投資者對復星醫藥給予了高度認可及期待。
截至2020年7月23日收盤,復星醫藥A股股價漲停,收報人民幣47.60元,H股股價漲幅為10.13%,至38.05港元,A、H股股價均創出年内新高。除此之外,復星醫藥股價近期更是上演了逆市上漲的好戲,成為二級市場最受追捧的避險品種之一。據富途終端數據統計顯示,截至7月13日至7月23日,短短十天時間里,復星醫藥A股股價(不復權)累計漲幅為33.93%,H股股價累計漲幅為39.79%,分别高於同期上證指數的-1.72%及恒指指數的-1.81%。其中,H股累計漲幅分别高於同期抗疫概念股康希諾生物-B的0.35%及國藥控股的-3.04%。
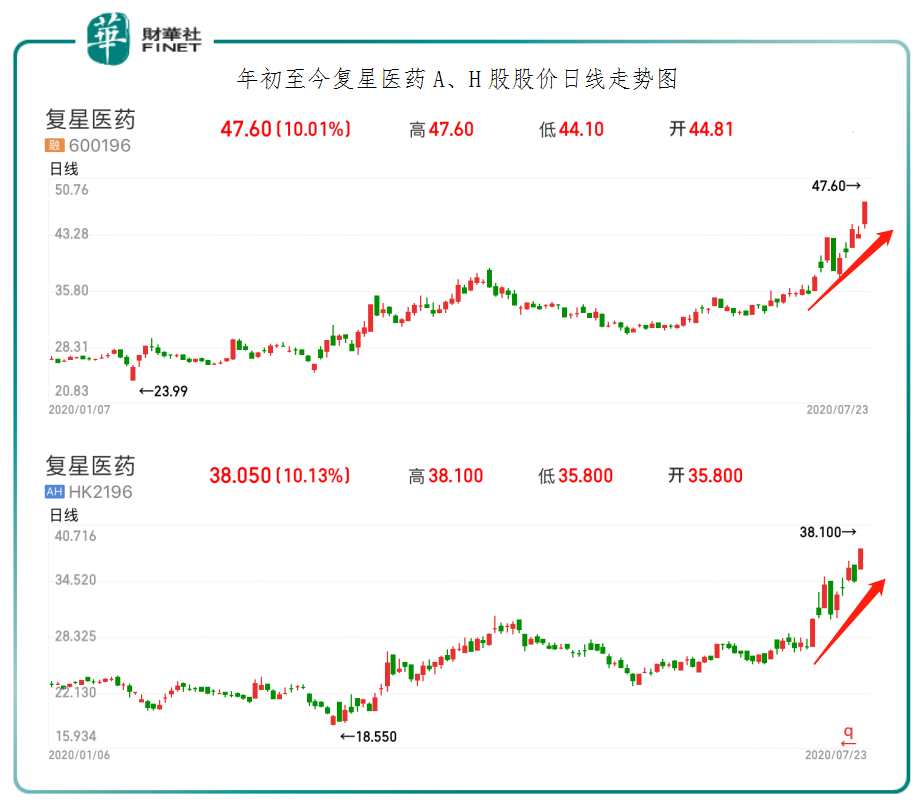
短時間内,復星醫藥股價逆市造好及跑赢同期抗疫概念股,除了受新冠病毒mRNA疫苗獲批臨床利好驅動外,其較高的安全邊際亦是受追捧的另一大影響因素。據Wind終端數據顯示,截至7月23日收盤,復星醫藥A股市盈率(TTM)為38.3倍,低於A股生物疫苗板塊市盈率的60.04倍;H股市盈率為27.8倍,低於H股抗疫概念板塊的34.2倍。因此,從估值角度來看,復星醫藥股價雖創新高,但估值相對同業及版塊依舊比較吸引。中泰證券研究報告表明,BioNTech公司具備綜合研發實力強、技術多樣化、高產能等優勢,疊加mRNA疫苗技術平台本身的優勢,復星醫藥和其合作有望快速推進新冠病毒疫苗的產業化。BNT162b1此次在國内獲批臨床,基於海外臨床數據預計後續有望快速推進,為疫情抗擊貢獻力量。
財華網所刊載內容之知識產權為財華網及相關權利人專屬所有或持有。未經許可,禁止進行轉載、摘編、複製及建立鏡像等任何使用。
如有意願轉載,請發郵件至content@finet.com.hk,獲得書面確認及授權後,方可轉載。
更多精彩內容,請登陸
財華香港網 (https://www.finet.hk/)
財華智庫網(https://www.finet.com.cn)
現代電視 (https://www.fintv.hk)