港股市场也即将迎来一家辅助生殖基因检测公司:贝康医疗。贝康医疗是NGS细分市场—生殖领域的领军龙头企业,致力于高通量测序技术在生育健康领域的研发和临床应用。
公司主要产品PGT-A试剂盒是首个也是唯一一个获国家药监局批准在中国进行商业销售的PGT试剂产品,对比公司国内外潜在竞争对手候选产品距离获得药监局批准仍有数年之遥。
身处基因检测生命科学赛道,产品竞争优势明显,贝康医疗有望成为香港市场第一支NGS基因检测第一股,这为公司在港股打响第一枪,挣得良好估值打下基础。
目前贝康医疗已通过上市聆讯,中信证券为独家保荐人,公司最快将于下周初招股,计划集资最少2亿美元(约15.6亿港元)。
贝康医疗优势较为明显,公司是中国辅助生殖基因检测解决方案的创新平台,具有首个也是唯一一个获国家药监局批准的三代试管婴儿基因检测试剂盒。
公司的PGT-A试剂盒是中国第一款在国家药监局批准、且第一个实现商业化的三代试管婴儿基因检测试剂盒。
该试剂盒用于在胚胎植入母体前,来检测试管婴儿过程中胚胎的非整倍体,即染色体数目异常。
公司在2014年开始开发PGT-A试剂盒,并已经于2020年2月获得国家药监局的三类医疗器械注册证,并于2020年4月开始启动商业销售PGT-A产品。
在往绩记录期,公司仅将PGT-A试剂盒的销量作研究用途,同期PGT-A试剂盒的平均售价及销量分别约为1253元及32388件。
同时,贝康医疗也是中国唯一一家拥有涵盖整个生殖周期,并具有显著技术优势的创新平台,公司目前拥有5款自主研发的检测试剂盒产品。
产品组合包括植入前胚胎的基因检测试剂盒(PGT-A、PGT-M和PGT-SR产品),以及可以分别用在产前及产后阶段检测遗传病的CNV和WES试剂盒。
除PGT-A试剂盒已经取得国家药监局三类医疗器械注册证外,其他4个产品正处于注册检验或临床前阶段。
其中PGT-M试剂盒是检测植入前试管婴儿胚胎中的单基因缺陷,其无需进行患者特定预实验生产流程验证,从而将结果生成时间从约两个月缩短为两周,还能为患者减少检测费用。
该试剂盒以无需预实验步骤、速度更快、成本更低,和数据分析、解读更准确的优势,已经于2020年11月完成国家药监局注册检验,目前正在接受医院伦理审查,并预计于2022年获国家药监局三类医疗器械注册证。
PGT-SR检测植入前试管婴儿胚胎中染色体结构重排,包括缺失、重复、倒位和异位。由于不同染色体存在多种潜在结构重排,故而需要非标准化、定制测试,导致该检测大规模临床应用相对困难。
但公司的PGT-SR试剂盒为检测染色体结构重排提供有效临床解决方案,且生产时间更短、费用更少,进而可能成为中国第一个具有大规模临床应用潜力的标准化商业产品,并预期于2024年获国家药监局注册批准。
PGT-A、PGT-M和PGT-SR三款试剂盒均是基于二代测序(NGS)技术,共同构成了PGT领域一个完整检测试剂盒系列,进一步巩固贝康医疗在三代试管婴儿基因检测试剂盒市场的主导地位。
除自主开发产品外,公司还分销达安生产的非侵入式产前检测试剂盒NIPT,和获国家药监局批准用于PGT的唯一NGS测序仪DA8600。其中后者是全球主流的NGS平台之一,是中国批准用于PGT的唯一一个测序仪。
探究贝康医疗之所以能成为NGS细分领域龙头企业,以临床为导向的研发模式、强大的研发能力,以及具有成功经验的专业知识,是公司竞争力的关键驱动。
从研发投入就能看出公司对技术的重视。2018、2019年,公司研发开支总额分别为1880万元,1990万元,2020年9月30日止九个月为2200万元,分别占当期营业收入比重分别为57.7%、35.7%、38.4%。
在以临床为导向的研发模式下,公司拥有强大的研发能力,可开发一站式、定制化综合的生殖遗传学解决方案。
公司不仅自主研发了覆盖全生殖周期的检测试剂盒,还开发了一套专注于胚胎检测、管理和存储的硬件,以补充基因检测试剂盒产品。
目前公司已经开发一种可自动处理和管理胚胎检测的自动化工作站,以及中国第一个用于胚胎储存的全自动、全数字化智能超低温存储仪,成为同类产品中第一个获得欧盟CE标识(健康和安全的金标准)的胚胎存储设备。
除了自主开展研发项目外,公司还与中国大型医院及生殖诊所、全球生命科学及生物技术公司、学术机构等主要业务伙伴合作,以联合建立实验室等多重合作方式来满足一线临床治疗最迫切的需求。
三代试管婴儿在中国发展历史短暂。首个服务提供商许可证于2001年颁发,2019年中国具有执业资格的也仅有70家医院和生殖诊所,对新设备及技术有着巨大的渴求。
贝康医疗针对个性化需求,为客户提供一站式定制化综合解决方案。不仅仅提供检测试剂盒和硬件设备及仪器,还提供实验室设计、运作和管理,售前和售后技术支持等意见和指引等,帮助客户从零开始建立并进一步提升生殖基因检测、分析和咨询能力。
基于在PGT领域优势地位,贝康医疗还参与起草国家《胚胎植入前染色体非整倍体检测试剂的质量控制技术评价指南(高通量测序法)》,参与制定PGT-A产品的国家标准,起草中国第一部PGT技术质量指南和国家行业标准。
覆盖整个业务链条的研发模式奠定贝康医疗综合能力和行业地位。拥有最先进的平台,贝康医疗具有研发、产品制造、注册到商业化的综合能力,更有利于公司将创新技术转化为大众化的商业产品。
在获得第一张商业化门票后,公司大规模生产箭在弦上。目前贝康医疗开始筹划对PGT-A试剂盒进行商业化规模生产。
公司在苏州拥有1364平方米的生产厂房,按照中国GMP要求设计,拥有两间符合国际清洁等级划分标准ISO14644-1清洁等级标准的ISO7级清洁车间,产能每年400万人份。
值得称道的是,该生产厂房生产线高度自动化,可以生产和组装所有内部开发的产品。
贝康医疗所处的赛道正是生命科学的风口。
虽然三代试管婴儿在中国刚刚起步,基于庞大的人口基数,以及人们对试管婴儿治疗在内的PGT的认识和接受程度不断提高。
中国政府于2016年出台政策在中国推广PGT。在政策催化下,获国家卫健委颁发PGT许可证的医院和生殖诊所数量从2016年40家增加至2019年的70家,未来PGT中心还将继续增加。
在商业化推动下,PGT在中国的渗透率预期将从2019年的3.8%提高至2024年的18.4%。与美国2018年的渗透率35.2%相比,中国PGT的渗透率增长潜力巨大。
随着贝康医疗PGT-A试剂盒成功商业化,将加速中国PGT试剂市场快速增长。
市场规模方面,根据弗若斯特沙利文报告,按基于出厂价销售收入计,PGT试剂市场将从2020年的0.96亿元,增加至2025年的34亿元,复合年增长率为103.8%,并预期于2030年进一步增加至147亿元,2025年至2030年的复合年增长率34.2%。
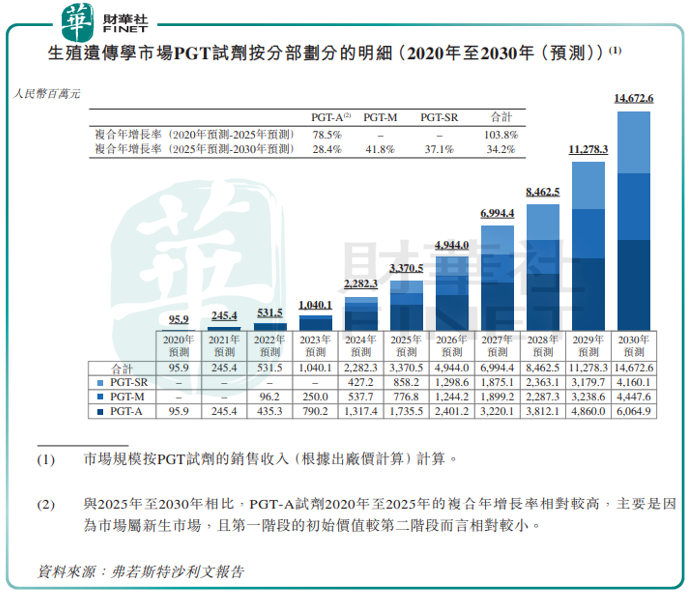
凭借在PGT领域领先地位,贝康医疗未来还想通过战略定位服务于更大的生殖遗传学医疗器械市场。
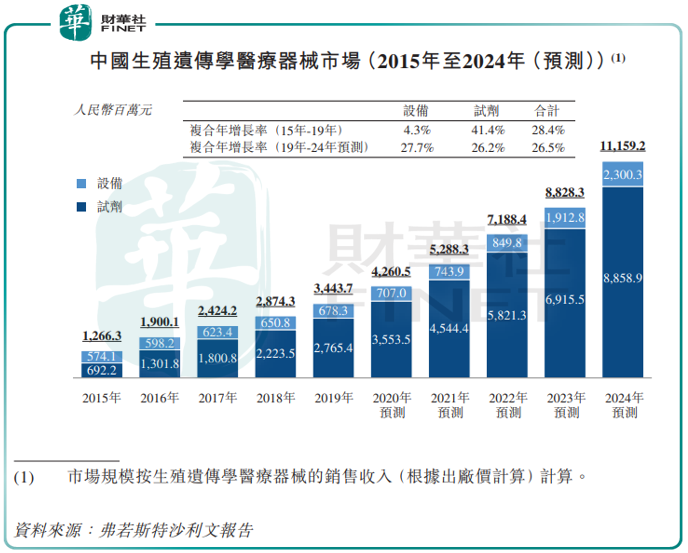
受不孕率日益提升、辅助生殖治疗需求不断增长,基因检测可购性不断增加,中国生殖遗传学医疗器械市场也在快速发展。
按基于出厂价计算销售收入计,已从2015年的13亿元增长至2019年的34亿元,复合年增长率为28.4%,并预期将于2024年达到112亿元,2019年至2024年的复合年增长率为26.5%。
在PGT领域占据领先地位,以及对更大市场的战略愿景,让贝康医疗备受资本青睐。招股书显示,成立时间不长的贝康医疗已经完成D轮融资,精通医疗行业投资的大鳄高瓴资本赫然在列,IPO前持股比例约为6.82%。
恒瑞方圆旗下中诚方圆二期持股7.59%,元禾控股旗下元禾原点持股6.15%;元生创投通过苏州新建元持股5.71%。
手握重磅商业化产品,在研资产管线覆盖整个生殖周期,NGS检测领域细分龙头贝康医疗能否在港股市场打响基因检测第一枪,让我们拭目以待。
财华网所刊载内容之知识产权为财华网及相关权利人专属所有或持有。未经许可,禁止进行转载、摘编、复制及建立镜像等任何使用。
如有意愿转载,请发邮件至content@finet.com.hk,获得书面确认及授权后,方可转载。
更多精彩内容,请登陆
财华香港网(https://www.finet.hk/)
财华智库网(https://www.finet.com.cn)
现代电视(http://www.fintv.hk)