近日,港交所IPO市場又接到另一家創新型生物科技企業冠科美博有限公司(下稱「冠科美博」)的上市申請書,摩根士丹利、美銀證券與華興資本為其聯席保薦人。
與國内本土創新型生物科技不同的是,冠科美博是由全球性的藥物發現和開發公司中美冠科生物技術(跨國企業)經過分拆重組而來。現階段,冠科美博主要專注於探索及開發可能與其他治療方法結合的腫瘤療法,以利用免疫系統和靶向特定分子信號通路來抑制癌症。
2015年5月21日,為了方便中美冠科生物技術進行分拆,冠科美博在開曼註冊成立。同年12月31日,中美冠科生物技術分拆位於中國台灣的附屬公司冠科藥業,並將其注入到新成立的冠科美博。至此,冠科美博就成為冠科藥業的母公司,並擁有包括APL-101(是一種新型的具有高度選擇性的小分子c-Met抑制劑)在内的多項臨床前項目的權力。
在冠科美博成立不久後,開始在美國、澳大利亞註冊分公司,主要業務是從事研發腫瘤單藥及聯合療法。而冠科美博進入中國市場則是在2018年。
2018年5月29日,冠科美博在杭州成立浙江冠科美博生物科技有限公司(下稱「浙江冠科美博」),主要業務同樣是從事研發腫瘤單藥及聯合療法。
不同的是,為了更快的在中國市場站穩腳跟,冠科美博給浙江冠科美博配備了最先進的研發設備,並採用國際先進技術建造中國生產基地,以支持公司產品的臨床前、臨床研究和最終商業化供應。
成立至今,冠科美博共進行了三輪融資,累計共融資約2.34億美元。其中,B輪融資中,B輪共融資約9,899.9萬美元,由招銀國際領投、奧博資本、佳辰資本、磐霖資本等機構跟投;C輪則共融資1.2425億美元,由平安領投,燕創、啓裕、億創等機構跟投。三輪融資資金冠科美博均用於日常營運和業務拓展,核心產品及在研產品的研發,以及營運資金。
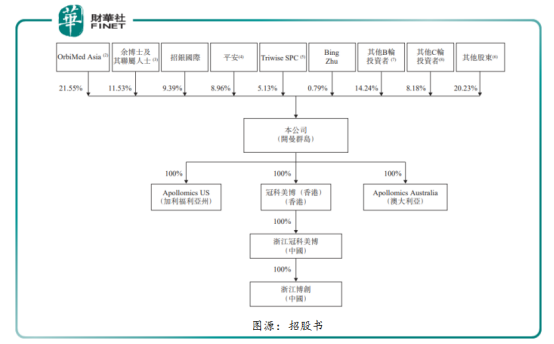
從上市前公司股權框架來看,奧博為冠科美博第一股東持有21.55%的股份,創始人、主席兼首席執行官餘國良及聯屬人士持有11.53%的股份為第二大股東,第三及第四股東分别為招銀國際及平安,分别持有為9.39%及8.96%的股份。
據了解,此次冠科美博擬赴港IPO,計劃融資2-3億美元。據招股書顯示,上市籌資資金用途為核心產品的研發、商業化過程中開發、制造以註冊為目的臨床試驗材料及工藝驗證提供資金。同時,對其他研發管線候選藥物的研發提供資金。
自2015年成立以來,冠科美博已建立一條由十種專注於腫瘤學的候選藥物組成(跨12個項目)的管線,其中五種候選藥物處於臨床階段。
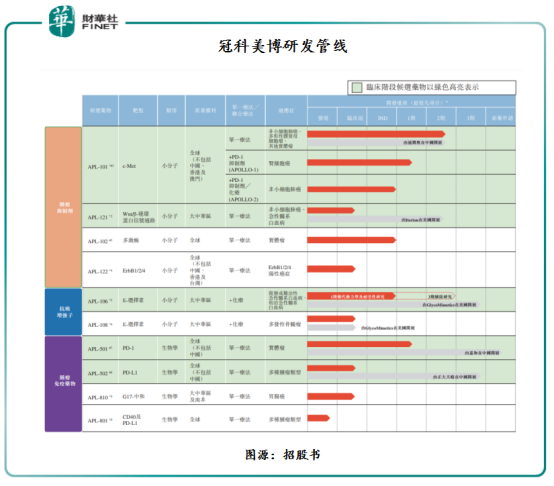
冠科美博現有研發管線可基於其作用機制分為三組,每組均包含處於不同開發階段的候選藥物。
第一組為「腫瘤抑制劑」,包含四種針對癌細胞中不同的不受控制生長信號通路的小分子抑制劑。
第二組為「抗癌增強子」,其可增強其他療法的抗癌效果。該組包含兩種針對一種細胞粘著受體的拮抗劑。
第三組為「腫瘤免疫藥物」,其可利用人體的免疫系統對抗癌症。該組包含四種候選藥物,包括針對癌細胞釋放免疫應答自然制動器的單特異性及雙特異性抗體,以及一種新型癌症疫苗。
在十種專注於腫瘤學的候選藥物組合中,冠科美博核心產品APL-101商業化前景較為可期。
APL-101臨床階段候選藥物之一,是一種針對多種腫瘤中靶向c-Met失調通路的新型、選擇性小分子c-Met抑制劑。其為一種具有選擇性且強效的c-Met受體激酶(於多種腫瘤類型中過度表達及╱或突變)的抑制劑。
目前,冠科美博將APL-101用作單藥,已完成對美國晚期惡性腫瘤及非小細胞肺癌中c-Met失調受試者進行的1/2期試驗(NCT03175224(即APL-101-01研究) ) 的1期部分。涉及c-Met失調的多個同期群的1/2期試驗的2期部分目前正在進行中。
據招股書顯示,冠科美博首要目標適應症為攜帶14號外顯子跳躍突變的非小細胞肺癌c-Met抑制劑初治受試者的二、三線治療。這主要驅動因素是c-Met抑制劑擁有不錯的市場潛力。根據灼識咨詢報告,2019年全球(中國除外)非小細胞肺癌發病人數為100萬例,預計到2030年將擴增至130萬例。其中,冠科美博深耕的美國市場,預計於2030年將達到約221,200例。
更值得關注的是,截至2020年12月31日,尚無c-Met 抑制劑於美國獲批用於治療多形性膠質母細胞瘤,且概無任何針對多形性膠質母細胞瘤的 c-Met抑制劑管線於美國食品藥品監督管理局註冊。
基於c-Met抑制劑的優勢,冠科美博便利用聯合試驗,來提高單藥療效。據招股書書顯示,冠科美博正在啓動c-Met抑制劑聯合試驗 APOLLO-1。APOLLO-1是一項進行中的1/2期試驗(NCT03655613),以評估APL-101及PD-1抑制劑在澳大利亞及新西蘭實體瘤受試者中的聯合療效。該試驗正處於劑量遞增階段。
除此之外,還有聯合試用項目APOLLO-2。APOLLO-2為一項在美國進行的APL-101聯合標準療法(帕博利珠單抗或培美曲塞╱鉑類化療)對美國初治轉移性14號外顯子跳躍突變的非小細胞肺癌受試者進行的1/2期試驗。據招股書顯示,冠科美博已於2020年9月向美國食品藥品監督管理局提交了APOLLO-2的臨床試驗方案,並於2021年1月及2月提交了更新的臨床試驗方案。
據冠科美博招股書數顯示,倘若於2024年初前,獲相關監管機構授出上市批準,則計劃屆時於美國及歐洲開始首次商業化推出APL-101。
雖著核心產品APL-101不管單藥還是聯合用藥都有著不俗市場空間,但同樣存在不小的挑戰及不確定性。
據招股書顯示,就APL-101有關的肝毒性研究結果相關的近期臨床試驗開發與美國食品藥品監督管理局通訊,而且冠科美博已採取相應的緩解措施,包括向美國食品藥品監督管理局提交APL-101-01研究的經更新方案,以及要求APL-101-01研究的相關研究者立即於開展研究時進行若幹調整,並監控APL-101-01研究2期中受試者的安全情況。
截至2021年2月8日(美國東部標準時間),在APL-101- 01研究2期部分給藥的患者中,合計38名患者使用APL-101,就有六名患者出現APL-101相關天冬氨酸轉氨酶、谷丙轉氨酶或總膽紅素升高達到3級或更高級别的情況,其中三名患者出現嚴重不良事件及三名患者出現不良事件。
就38名患者而言,終止邊界為十名患者。倘若相關肝損傷事件的數量達到終止邊界,冠科美博招募將終止且安全審查委員會將開會,以進一步評估任何適當的步驟。如此一來,這勢必會給APL-101臨床試驗進度帶來一定影響。
從過往臨床試驗來看,冠科美博有終止試驗的案例。據招股書顯示,由於聯合療法在有關適應症中不耐受,曾終止了APOLLO-1(即APL-501聯合APL-101)試驗的肝細胞癌組。
綜上所述,即使候選藥物擁有可觀的前景及市場空間,但在候選藥物未進行商業化銷售之前,候選藥物可安全及有效地用於各項目標適應症的結果,都有可能給公司商業化帶來變數。
文:從心
財華網所刊載內容之知識產權為財華網及相關權利人專屬所有或持有。未經許可,禁止進行轉載、摘編、複製及建立鏡像等任何使用。
如有意願轉載,請發郵件至content@finet.com.hk,獲得書面確認及授權後,方可轉載。
下載財華財經APP,把握投資先機
https://www.finet.com.cn/app
更多精彩内容,請點擊:
財華網(https://www.finet.hk/)
財華智庫網(https://www.finet.com.cn)
現代電視FINTV(https://www.fintv.hk)