國内創新藥研發如今已經進入遍地開花的時代,尤其是腫瘤賽道吸引大量人才和資本湧入,催生了衆多biotech公司,也造成了從靶點選擇到臨床開發再到商業化競爭全面内卷的局面。去年,先是CDE發布《以臨床價值為導向的抗腫瘤藥物臨床研發指導原則》,再有資本市場出現大面積的biotech公司估值縮水或新股破發,再到今年2月信迪利單抗美國BLA遇阻。有分析認為,中國的創新藥研發到了重新抉擇方向的關鍵時刻。
業内人士表示,針對「臨床未滿足需求」的新藥研發是破局之道,而且「臨床未滿足需求」並不局限于腫瘤疾病。近兩年可以明顯感受到眼科、皮膚、疼痛、腎病等專科領域的新藥投資和研發布局逐漸升溫。外界對于某個具體疾病市場潛力的認知很大程度上會受到該領域成功上市的重磅炸彈藥物的影響。以眼科領域為例,除Eylea(阿柏西普)、Lucentis(雷珠單抗)等極少數藥物外,耳熟能詳的重磅炸彈不多,造成眼科賽道的關注度遠不如腫瘤高的客觀現狀。
但一個難以忽略的事實是,眼科賽道的潛力巨大,藥物市場規模也在快速增長。目前已知的眼科疾病超過500種,幾乎涉及全年齡段人群。據WHO統計,全球目前至少有22億盲人和視覺障礙患者,其中近視、幹眼症、白内障、青光眼、眼底血管病變等疾病都十分普遍,而針對這些對于患者生活産生重大影響的眼科疾病,真正安全有效可負擔的治療選項相對局限,存在巨大的「臨床未滿足需求」。此外,受老齡化、電子産品大幅普及等諸多因素的影響,眼病群體還在持續擴大,臨床需求與市場規模還在快速攀升。根據中金研報的數據,2020年中國眼科用藥市場總規模接近200億元,預計2030年將達到1350億元。其中,幹眼症、wAMD、近視位列眼科藥物市場前三位。
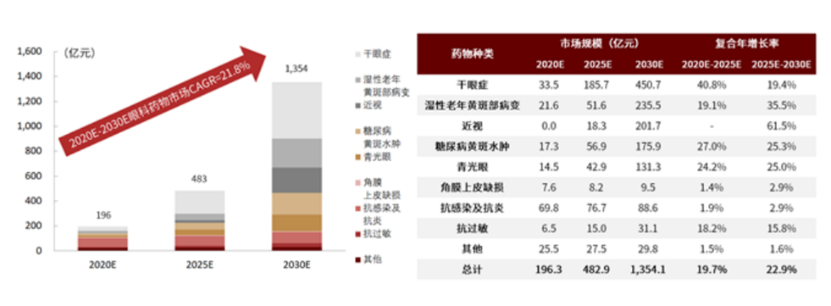
按適應症劃分的中國眼科藥物市場狀況(來源:中金研報)
2021年,國家衛健委出台了《十四五」全國眼健康規劃(2021-2025)年)》明確政府致力于建立健全國家-區域-省-市-縣眼科醫療服務體系,加強二級及以上綜合性醫院眼科的建設,鼓勵醫療機構增加購買眼科相關藥品和醫療器械。
眼科賽道近年來的升溫讓一些新興biotech和老牌pharma公司均受到了較大的關注,逐漸站上了風口,比如極目生物、維眸生物、紐福斯、歐康維視、兆科眼科、億勝生物(01061.HK)、康弘藥業、興齊眼藥、恒瑞醫藥等。業内人士指出,幾家公司的眼科業務雖無直接可比性,但若從眼科業務的完整性、産品管線的豐富性、布局思路的清晰度來看,港股上市的億勝生物尤其值得關注。
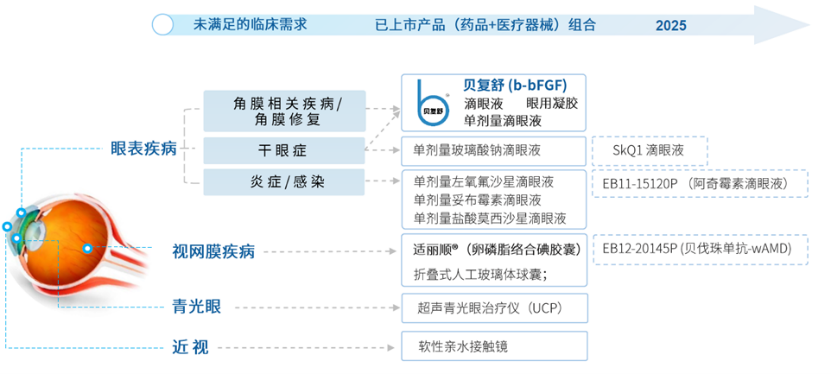
億勝生物眼科産品組合(來源:億勝生物公開資料)
資料顯示,億勝生物以創新的牛堿性成纖維細胞生長因子(bFGF)系列産品貝復舒滴眼液、眼用凝膠、單劑量滴眼液為基礎,從治療眼表創傷修復切入,通過持續創新促進産品升級叠代,同時以代理、收並購、項目研發合作等方式逐步建立了覆蓋從眼表到眼底疾病的産品組合,布局的適應症包括幹眼症、濕性AMD、近視、青光眼等,均是眼科賽道未來最具潛力的高增長業務領域。加上多年打造的自營銷售網絡和潛力重磅新藥儲備,億勝生物已事實上成為國内具有代表性的領先眼科藥企之一。
bFGF産品貝復舒與貝復濟系列:創新基因支撐公司快速增長
億勝生物于1990年組建團隊和投資建廠,用于研發具有促進靶細胞損傷修復作用的基因工程新藥bFGF。在以化學原料藥和低端仿制藥為主流的上世紀90年代,億勝就確立了通過大力投入資金和研發做真正優質創新藥物的堅實理念。作為億勝生物起家産品的眼科貝復舒與外科貝復濟系列是公司目前的業務基本盤。
1999年,億勝生物成功開發了國家一類基因工程新藥貝復舒滴眼液,用于促進角膜修復,是全球首個上市的bFGF滴眼液。2006年,第二代産品貝復舒眼用凝膠制劑上市,相較于滴眼液延長了藥物在眼部的作用時間,在患者使用方式上與貝復舒滴眼液形成支撐與補充。2019年,基于領先的「吹-灌-封」單劑量生産平台推出了第三代産品——貝復舒單劑量滴眼液,該産品不含防腐劑,更適合術後及幹眼症等眼睛狀況敏感或需長時間使用的患者。2021年,貝復舒系列實現銷售額4.29億港元,是衆多眼科品牌里的一個較大品種。
貝復舒是目前臨床上角膜修復一線用藥,該産品現階段主要適用人群是來自門診的角膜損傷患者。隨著不含防腐劑單劑量劑型的上市,貝復舒在「門診+角膜損傷」這兩個原定範圍均有所拓展,展現出可觀的市場潛力。
首先是從門診到手術的擴展。《中國藥典2020版》明確提到,供手術用的眼用制劑均不得添加抑菌劑或抗氧化劑等附加劑,且應采用一次性使用包裝,可見單劑量貝復舒滴眼液産品作為眼科術後修復用藥大有可為。
根據中金報告的測算數據,以國内屈光手術為例,該類型的手術量近年來獲得快速上升,2022年預計為111.8萬台,2030年預計達350.1萬台;白内障手術量預計2022年為461萬台,2023年將達1044萬台。在這樣一個可觀的眼科手術量增速之下,貝復舒業績釋放也有望保持一個長期穩定、快速的節奏。
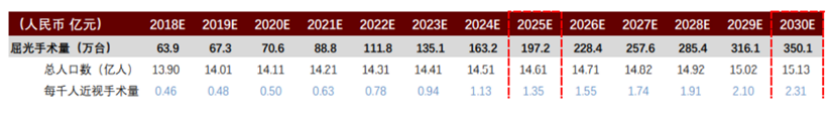
國内屈光手術市場規模測算(來源:中金研報)
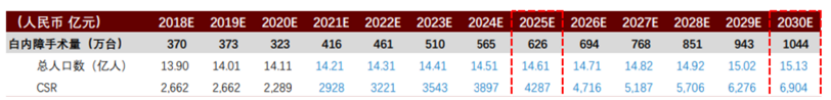
國内白内障手術/人工晶體市場規模測算(來源:中金研報)
其次是從角膜損傷到幹眼症的擴展。幹眼症人群規模較大,在歐美國家認知度較高,在中國認知度相對不足。一般觀點認為,全球幹眼症患者超過3.5億,其中中國患者超過7500萬。貝復舒獲批的適應症涵蓋中輕度幹眼症,2019年推出針對幹眼等眼部敏感人群的不含防腐劑劑型,在2020年又被納入《中國幹眼專家共識》。
分析人士認為,貝復舒在幹眼症領域的放量增長是大概率事件。預計未來,貝復舒系列産品有望憑借較全的劑型、醫保覆蓋優勢、強有力的銷售渠道和臨床學術市場認可度占據一個顯著的競爭優勢。
SkQ1:全球首創全新作用機制分子,有望填補幹眼症臨床需求
億勝生物眼科管線中的另一個亮點是用于治療幹眼症的first in class全新分子SkQ1,這款産品也是全球眼科新藥管線中值得關注的一個。
幹眼症屬于眼表疾病,是典型的多機制復雜疾病。傳統觀點認為,環境、感染、内源性負荷、抗原或遺傳等諸多因素都有可能誘發幹眼症。近年來,幹眼症的發病機制研究更多關注機體免疫活動等激發炎症級聯反應,以及其中促炎症細胞因子、趨化因子、間質金屬蛋白酶等分子信號通路的參與情況。
長期以來,包括環孢素、人工淚液等多種藥物用于治療幹眼症雖能一定程度上緩解疾病,但總體治療效果不盡如人意。理想的幹眼症治療目標要從症狀(Symptom)和體征(Sign)兩方面實現改善。症狀主要是記錄受試者感受的主觀指標,包括幹燥、灼熱、不適、疼痛等多方面感受,通過受試者評分表格評估。體征則是客觀指標,類似角膜/結膜細胞染色、淚液裂解時間等内容。FDA既往批准的幹眼症藥物從標簽上看都是針對個別指標,改善程度有限。
直到2016年,Shire開發的Lifitegrast才真正作為首個同步改善幹眼症患者症狀和體征的藥物獲得FDA批准。Lifitegrast核心機制是阻斷胞内黏附分子-1(ICAM-1)與淋巴細胞功能相關抗原(LFA-1)的相互作用,從而抑制T細胞的活動,達到抑制眼表炎症反應的作用。該藥物的獲批證實針對炎症反應開發幹眼症藥物是可靠的,同時也為幹眼症藥物的臨床路徑提供了標杆。受此鼓舞,幹眼症創新藥的開發熱度快速提升。
億勝生物在2018年7月與Mitotech簽訂SkQ1滴眼液的産品引進和全球共同開發協議,並先後兩輪投資近4000萬美元用于在美國進行III期臨床試驗。SkQ1通過靶向線粒體來治療幹眼症,作用機制非常獨特。具體而言,SkQ1分子結構的一部分起著分子「拖車」的作用,將分子的另一部分——一種非常活躍的抗氧化劑質體醌帶入線粒體,清除線粒體中堆積的氧化應激産物(ROS),恢復眼部細胞功能,同時抑制淚液中炎症因子生成。
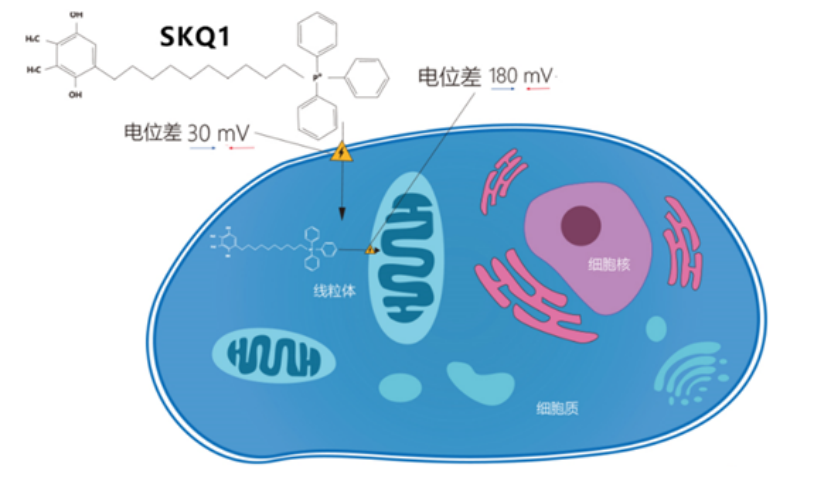
SkQ1治療幹眼症作用機制(來源:億勝生物公開資料)
SkQ1滴眼液通過三重作用機制治療幹眼症,通過靶向阻斷眼部氧化應激反應,不僅可減輕炎症反應,更是能改善眼組織退化、淚液質量下降等問題,預期有望比當前主流的Lifitegrast和環孢素類藥物起到更優的療效,同時具有4周快速見效的效果,優于現行多數采用抗炎機制的治療手段。
2018年10月,SKQ1完成美國III期試驗首例患者入組。2019年7月,IIb/III期VISTA-1試驗的關鍵數據發布。2021年2月,III期VISTA-2試驗的關鍵數據發布。通過已開展的兩項VISTA試驗的設計可以看出,SKQ1針對幹眼症臨床終點的選擇均對標Lifitegrast的臨床設計,同步引入Symptom(異物感、不適感等)和Sign(角膜、結膜熒光染色等)改善作為評價指標,希望通過更高標准的驗證,在臨床使用獲批中取得更明確和廣泛的標簽。受海外疫情影響,SKQ1的VISTA-3study延至 2022年底啓動,預計2023提交NDA。
適麗順:眼底疾病潛在重磅品種
2022年3月,億勝生物完成了適麗順(卵磷脂絡合碘膠囊)的收購。卵磷脂絡合碘是一款以碘作為中心原子,卵磷脂作為配位體,以共價鍵結合的新型化合物,是國内治療眼底疾病唯一口服有效的有機碘劑。
通過加強眼底代謝促進出血滲出和水腫的吸收,適麗順對所有的眼底滲出均有促進吸收的作用,被批准用于玻璃體出血、渾濁、中漿中滲、視網膜中央靜脈阻塞,在臨床上同時還廣泛用于視網膜出血、黃斑水腫的吸收,可以縮短一些眼底疾病的病程,提高患者治療依從性。
這款産品的主要市場拓展渠道在于門診。綜合各種渠道數據,我國眼科門診量每年大約1億人次,其中眼底疾病患者比例大約10%,也就是1000萬人次左右,其中伴有出血滲出水腫的病例占比為70%~80%,這類患者中有50%左右使用口服藥物治療。如果再根據適麗順的處方比例及處方用量,即可大致推算出適麗順的年度銷量。眼科門診量每年增速約6%,適麗順的增長空間相當可觀。
需要留意的是,醫藥行業的宏觀政策給所有醫藥企業都帶來了不確定性,卵磷脂絡合碘目前僅有原研(沃麗汀)與適麗順兩款産品,未來幾年列入帶量采購的可能性較低。
業内人士稱,適麗順未來增長的有利因素在于患者數量增加、處方比例提升、用藥療程規範等,有望成為重磅品種,這也有賴于億勝在醫院渠道上的開發和學術推廣力度。
貝伐珠單抗眼用注射劑:wAMD臨床開發快速推進
年齡相關性黃斑變性(AMD)屬于視網膜疾病,主要病變部位是視網膜的黃斑區。黃斑區是視覺最敏感的部分,發生退行性病變後對精細視覺、色覺都有明顯影響,嚴重影響中心視力。AMD現已成為繼青光眼、白内障之後全球第三致盲因素,是60歲以上人群失明的主要原因,也是當下眼科創新藥研發的又一熱點。
AMD過往一直缺乏有效藥物,直至2006年Lucentis獲批上市,通過靶向VEGF的抗體或融合蛋白治療濕性(wAMD)從此成為該領域的重點研發方向,之後出現的Eylea以及國産重磅藥物康柏西普等均是成功的大品種。貝伐珠單抗作為最著名的VEGFR抑制劑之一,在Lucenti獲批之前,就已經開始廣泛用于治療AMD在内的眼科疾病(即便其沒有正式獲批的眼科適應症),這為其治療眼科疾病的有效性與安全性提供大量真實世界證據。
億勝生物在2020年10月與復宏漢霖簽訂協議合作開發EB12-20145P(HLX04-O)貝伐珠單抗眼用注射液用于治療wAMD等眼科適應症。億勝擁有該産品在全球範圍内針對眼科適應症進行開發、生産、監管備案及商業化的獨家許可。該項目目前已獲批准在美國、新加坡、俄羅斯、歐盟多國開展三期臨床試驗,並已分別在中國、歐盟、澳大利亞完成首例患者給藥。從臨床試驗的快速推進可以看出,億勝生物在引進項目的落地開發方面具有很強的執行力。
藥品+器械:從眼表到眼底疾病的完整布局
眼科疾病種類繁多,億勝生物上述幾款創新藥品及器械組合覆蓋了角膜損傷、幹眼症、眼部炎症/感染、青光眼、年齡相關黃斑變性等幾個疾病方向。除此之外,億勝還在推出一系列不含防腐劑單劑量眼科産品,包括單劑量妥布黴素滴眼液、單劑量左氧氟沙星滴眼液、單劑量鹽酸莫西沙星滴眼液、單劑量玻璃酸鈉滴眼液,以順應國際上眼科制劑不含防腐劑的的發展趨勢。
億勝生物作為國内最早布局眼科創新藥的企業之一,在2015年就建立了BD團隊專注豐富産品線,通過制訂覆蓋眼表、青光眼及眼底(wAMD)疾病的多方位策略及深度覆蓋全國的眼科銷售網絡,建立起眼科領域的堅實市場地位和壁壘。
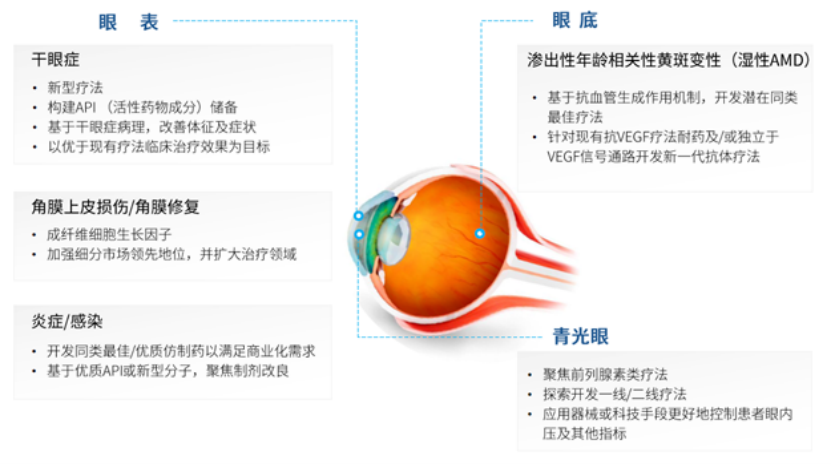
億勝生物眼科産品開發策略(來源:億勝生物公開資料)
2020年,億勝在全球完成四大研發中心(中國、新加坡、美國、英國)的布局,未來將通過自研以及「增進計劃」(BD)給億勝的眼科産品管線持續輸送創新「彈藥」。
除了眼科藥品,億勝生物在眼科器械方面也有布局,引進超聲青光眼治療儀EyeTechCare、折疊式人工玻璃體球囊、針對近視的軟性親水接觸鏡(蝶適)等産品。憑此,億勝生物打造了「藥品+器械」的上市産品組合,協同放大自己在眼科領域的優勢。
創新藥發展的億勝模式
回顧億勝生物以創新為主導的業務發展路徑,其早在90年代就開發上市了全球首個bFGF藥品,可以說是天生攜帶創新基因。在後續産品線和業務的拓展方向上,億勝生物沒有盲從行業風口,而是選擇聚焦自身優勢的眼科領域進行重點布局,自主研發與外部合作雙線並舉。
在支持公司長遠發展的研發投入方面,億勝生物也不吝惜,2021年公司研發總支出2.08億港元,占收入比重12.7%,在疫情艱難時刻仍然保持對研發的大幅投入,可見公司對于創新升級的堅定信心與決心。分析人士表示,這套打法務實而不花哨,多年來穩步推進,打下了紮實的業務基礎。隨著眼科賽道快速升溫,管線的持續豐富,重磅産品的逐步上市,億勝生物未來兩年有望逐步進入收獲期,為患者和市場帶來更多驚喜。
該分析人士指出,億勝進軍創新藥的路徑,或許能為其他本土藥廠提供思考:創新藥的轉型升級不要好高骛遠或者盲目跟風紮堆,應基于自身情況,找准最合適切入的賽道或者疾病領域,圍繞該領域的未滿足臨床需求做延展性的協同布局,同時充分對接自身的營銷優勢,加深自己的護城河,走一條低風險、高收益的道路。市場的未滿足臨床需求並不少,研發機會也是如此。未必每家企業都能復制恒瑞或者百濟的創新藥布局模式,但是億勝生物在眼科賽道特色發展之路還是有不少可以借鑒的地方。
來源:發布易
財華網所刊載內容之知識產權為財華網及相關權利人專屬所有或持有。未經許可,禁止進行轉載、摘編、複製及建立鏡像等任何使用。
如有意願轉載,請發郵件至content@finet.com.hk,獲得書面確認及授權後,方可轉載。
下載財華財經APP,把握投資先機
https://www.finet.com.cn/app
更多精彩内容,請點擊:
財華網(https://www.finet.hk/)
財華智庫網(https://www.finet.com.cn)
現代電視FINTV(https://www.fintv.hk)